近日,,我校第一附屬醫(yī)院檢驗科周建博士與廣州大學等單位合作在國際知名期刊《Nature Communications》發(fā)表了最新研究成果“Evolved cytidine and adenine base editors with high precision and minimized off-target activity by a continuous directed evolution system in mammalian cells”。該研究設計了一種基于哺乳動物的CRISPR/Cas堿基編輯器進化系統(tǒng),,大大提高了堿基編輯器的優(yōu)化效率,,對于基因編輯技術(shù)的進一步應用具有重要意義,。

CRISPR/Cas技術(shù)是一種有效的堿基編輯器,然而人們在應用其進行基因編輯的過程中發(fā)現(xiàn)尚存在一系列問題,?;贑RISPR/Cas堿基編輯系統(tǒng)存在的off target,、Indel,以及編輯窗口內(nèi)的非特異性的編輯,,往往導致編輯產(chǎn)物純度低下,,基因編輯的精確性差。為了解決基于CRISPR/Cas系統(tǒng)進行堿基編輯過程中存在的問題,,需要持續(xù)不斷地對其進行優(yōu)化,,以降低off target、降低Indel,、縮小編輯窗口,,提高編輯特異性以及編輯產(chǎn)物的純度。
目前已經(jīng)建立的堿基編輯器(BE)的連續(xù)定向進化已經(jīng)在細菌細胞中取得成功,,但在哺乳動物細胞中尚未實現(xiàn),。本研究報告了哺乳動物細胞連續(xù)定向進化系統(tǒng)(CDEM)的發(fā)展。CDEM能使BE以全長的方式與Cas9酶一起進化,。利用CDEM進化胞嘧啶堿基編輯器BE3,,腺嘌呤堿基編輯器ABEmax和ABE8e的脫氨酶。在BE4結(jié)構(gòu)上進化的胞苷脫氨酶變異體不僅顯示出狹窄的編輯窗口,,而且具有更高的編輯純度和低脫靶活性,。進化的ABEmax和ABE8e縮小了編輯窗口或改變了編輯窗口位置,并降低脫靶效應,。研究結(jié)果表明,,CDEM是一種簡單而有效的CRISPR/Cas堿基編輯系統(tǒng)定向進化方法,可以在哺乳動物細胞中不受進化片段大小限制的定向連續(xù)進化堿基編輯器,。
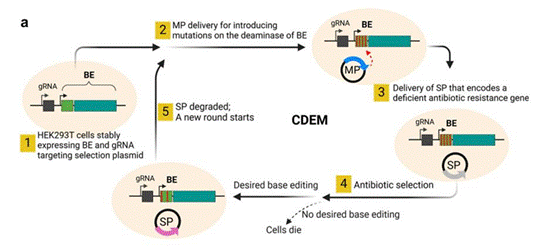
基于CRISPR/Cas堿基編輯器連續(xù)定向進化系統(tǒng)(CDEM)的原理示意圖

利用CDEM進化胞嘧啶堿基編輯器BE3,,在BE4結(jié)構(gòu)上進化的胞苷脫氨酶變異體不僅顯示出狹窄的編輯窗口,而且具有更高的編輯純度和低脫靶活性

利用CDEM進化腺嘌呤堿基編輯器ABEmax和ABE8e的脫氨酶
原文鏈接:Zhao N, Zhou J, Tao T, et al. Evolved cytidine and adenine base editors with high precision and minimized off-target activity by a continuous directed evolution system in mammalian cells. Nat Commun. 2024;15(1):8140. doi:10.1038/s41467-024-52483-3.https://doi.org/10.1038/s41467-024-52483-3
